INTRODUCCIÓN
Dramáticos aumentos en las emisiones de amoníaco atmosférico se han alcanzado en los últimos años. La Unión Europea (UE), ha reportado que el sector agrícola es responsable de la gran mayoría de las emisiones totales de amoníaco (93,3%) siendo el principal causante el manejo de las heces durante la producción animal (Figura 1) [1]. Por otra parte, la Agencia de protección ambiental de los EE.UU (EPA) estima que la agricultura animal representa del 50 -85% de la volatilización total de amoníaco del país.
![Parte1-Img1-Final [Figura 1] Emisiones de amoníaco EU-28 (% del total de emisiones)](https://cladan.devorganics.com.ar/wp-content/uploads/2020/06/Parte1-Img1-Final.jpg)
[Figura 1] Emisiones de amoníaco EU-28 (% del total de emisiones)
El amoníaco (NH3), es un gas alcalino incoloro altamente irritante que impacta en el medio ambiente contaminando el aire, suelo y agua y en la salud de humanos y animales. Concretamente en la producción avícola, altos niveles de amoníaco puede dañar los ojos (conjuntivitis), el tracto respiratorio de las aves, lo cual a su vez aumenta la susceptibilidad a enfermedades respiratorias, y las garras, aumenta la incidencia de pododermatitis (Figura 2). Además, se han realizado importantes investigaciones para conocer el impacto del amoníaco sobre el rendimiento de las aves siendo el peso corporal y el índice de conversión alimenticia las variables más afectadas, aunque algunas investigaciones reportan mortalidad y cantidad de alimento ingerido [2].
Durante las operaciones de producción avícola la generación del amoníaco es a partir de la mineralización del nitrógeno orgánico de las heces y orina de las aves (ácido úrico y urea) mediada por la microbiota presente en la cama (Figura 2).
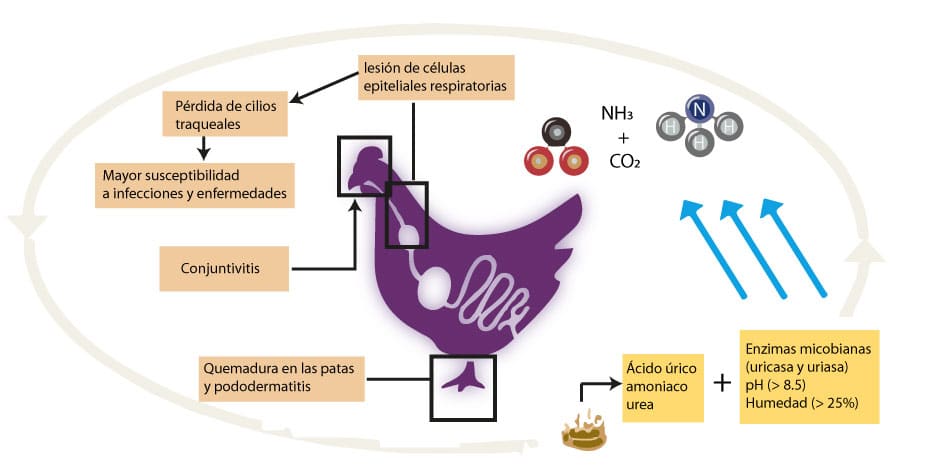
Figura 2 – Generación de amoníaco en la producción avícola
El empleo de la Cal en cualquiera de sus formas, durante el vacío sanitario y con los fines de “sanitizar” el ambiente, no hacen sino más que aumentar estas emisiones de amoníaco, al convertir toda sal de amonio fija en la cama en su forma gaseosa, contribuyendo así al efecto invernadero.
La microbiota de la cama es extremadamente diversa y varía durante el ciclo de cría, sus ciclos de reuso y la incorporación de hongos y bacterias derivadas del medio ambiente [3].
Debido a la acumulación de compuestos orgánicos (alimento, excretas, plumas), su pH y humedad, la cama ofrece condiciones óptimas para el crecimiento y la multiplicación de las principales bacterias de la microbiota fisiológica, especialmente Lactobacilos beneficiosos y Gram-positivos.
Sin embargo, estas condiciones también facilitan la multiplicación de patógenos, donde se destaca Salmonella spp, causando problemas relacionados con la seguridad alimentaria y E. coli y Clostridium, responsables de enfermedades en los pollos. De esta manera, en la cama se establece una coordinación y efecto dinámico en las poblaciones bacterianas presentes (benéficas y potenciales patógenos), y por tanto, las acciones de estas bajo ciertas circunstancia pueden causar problemas de salud en el lote y en otras ocasiones un efecto benéfico.
Finalmente, el tratamiento y manejo efectivo de la cama para el control del nivel de emisiones de amoníaco también puede resultar en el control de potenciales patógenos presentes evitando su efecto negativo significante sobre la salud y el desempeño de las aves.
EL ORIGEN DEL AMONÍACO EN LOS GALPONES
El ambiente en los galpones es la combinación de factores físicos y biológicos que actúan en un complejo sistema dinámico de interacciones. Por tanto, cada galpón avícola es un microambiente que genera calor, humedad, partículas volátiles y una gran amalgama de gases siendo el amoníaco el principal.
La descomposición microbiana constante de excretas y material de cama produce naturalmente amoníaco y otros compuestos orgánicos, siendo responsables por el olor asociado con los establecimientos pecuarios [4,5]. Los componentes del ambiente aéreo como la temperatura, humedad, polvo y patógenos pueden interactuar con el amoníaco y afectar el bienestar de las aves [6, 7, 8].
FACTORES FÍSICOS QUE INFLUYEN EN LA PRODUCCIÓN Y CONCENTRACIÓN DE AMONÍACO
Numerosos son los factores pueden influir en el aumento de la concentración de amoníaco en un galpón y este alcance los límites perjudiciales para las aves. Dentro de ellos se destacan: la temperatura y humedad externa e interna, la ventilación del galpón y la calidad de la cama.
Con el creciente costo de los materiales y la mano de obra, el reuso de la cama en varias crianzas se volvió una práctica habitual. Sin embargo, esto genera un deterioro en la calidad de la misma; dónde camas con costras, mayor humedad, pH y carga microbiana conllevan a la mayor generación de amoníaco por las bacterias que desdoblan el ácido úrico. La meta de un manejo efectivo de la cama es asegurar que la misma permanezca seca y friable.
La ventilación es primordial para renovar el aire dentro del galpón con el fin de diluir los organismos patógenos, evitar la acumulación de gases tóxicos como el amoníaco y regular la temperatura y humedad para la crianza de las aves. Sin embargo, durante el invierno, la reducción de ventilación, con el fin de mantener la temperatura y evitar costos extras en calefacción, causa un aumento de amoníaco en el aire. Trabajos de investigación han demostrado que una reducción de ventilación conlleva a niveles de concentración de amoníaco de 50-100 ppm [8].
MICROBIOTA DE LA CAMA Y PRODUCCIÓN DE AMONÍACO
Las aves reciben nitrógeno en forma de proteína y aminoácidos por el alimento, no obstante, debido al exceso administrado, una porción de este nitrógeno se elimina junto con las excretas en forma de ácido úrico y urea. En este punto, la microbiota de la cama es la encargada de la descomposición de estos compuestos y la consecuente producción de amoníaco. Distintos investigadores han demostrado el papel de los microorganismos en el desprendimiento de amoníaco mediante la esterilización de las excretas de los pollos [9]. Cuando este material se incubó posteriormente, se observó que el desprendimiento de amoníaco fue muy reducido.
La descomposición del ácido úrico en amoniaco requiere la actividad de numerosas enzimas microbianas, como la actividad enzimática degradante del ácido úrico (Uricasa) y la degradante de la urea (Ureasa) [10]. La primera reacción del proceso requiere oxígeno, temperatura y agua, y es mediada por la Uricasa (Ec. [1]), una metaloenzima que trabaja a un pH óptimo de 9.0 [11] mientras que en la segunda reacción, la actividad de Ureasa, considerada un factor limitante en la reacción de mineralización [12], es responsable de la producción final de amoníaco gaseoso (Ec. [2]).
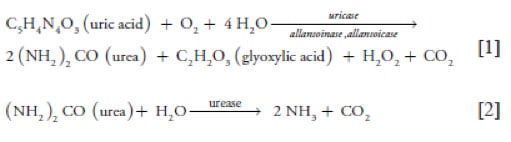
No todos los microorganismos capaces de descomponer el ácido úrico lo convierten completamente en amoníaco. Algunos sólo son capaces de degradar el ácido úrico a urea u otros intermediarios debido a la ausencia de las enzimas necesarias. Esta actividad enzimática depende del tipo de bacterias producidas en el tracto gastrointestinal de las aves, de la antigüedad, temperatura, humedad y pH de la cama. Por lo tanto, dentro de la cama y heces de las aves, es indispensable que existan poblaciones microbianas, con efectos combinados para la completa degradación del ácido úrico a amoníaco y dióxido de carbono [2].
Varios trabajos de investigación han demostrado que las poblaciones microbianas con actividad uricasa y ureasa tienen un efecto significativo sobre el ciclo del nitrógeno en la cama. En los últimos años, diagnósticos con una técnica moderna como la técnica de PCR en tiempo real, han revelado que los microorganismos dominantes en la producción de amoníaco en la cama son las bacterias del género Bacillus spp.[13] y Arthrobacter spp. [14] y los hongos Aspergillus spp. [10, 15,16] ya que son productores de uricasa y ureasa.
A pesar de estos avances, se conoce relativamente poco sobre la identidad y actividad de la microbiota de la cama durante la conversión de ácido úrico y urea a amoniaco. Por lo tanto, una mejor comprensión de estos microorganismos uricolíticos y ureolíticos puede conducir al desarrollo de mejores prácticas de manejo para reducir o eliminar estas poblaciones de la cama y la consecuente producción de amoníaco.

Referencias
- MARK KARIMI, MSC (2017). 5 tips to successfully manage poultry house ammonia levels.
- CARLILE, F.S. (1984). Ammonia in poultry houses: a literature review. Worlds Poultry Science Jorirnal 40(2):99-1 13.
- FIORENTIN, L. (2005). Aspectos bacteriológicos da reutilização da cama de aviários de frangos de corte
- OVIEDO, E. (2005). Manejo de la calidad de aire en Avicultura. Industria avícola. Octubre.2005.
- JODAS,S; HAFEZ, H.M. (2001). Manejo de la cama y enfermedades relacionadas de los pavos. Avicultura Profesional. 19(5): 17-21.
- KOON, J.; HOWES, J.R.; GRUB, W. AND ROLLO, C.A. (1963). Poultry dust: origin and composition. Agricultural Engineering 44: 608-609.
- DENNIS, C. AND GEE, J.M. 1973. The microbial flora of broiler house litter and dust. Journal of General Microbiology 78: 101-107.
- FEDDES, J.J.R. AND LICSKO, Z.J. (1993). Air quality in commercial turkey housing. Canadian Agricultural Engineering 35: 147-150.
- KITAI, K. AND ARAKAWA, A. (1979). Effect of antibiotics and caprylohydrozamic acid on ammonia gas from chicken excreta. British Poultry Science 20:55.
- ROTHROCK, M.J.,* KIMBERLY L. COOK, AND JASON G. WARREN (2010). Microbial Mineralization of Organic Nitrogen Forms in Poultry Litters. J. Environ. Qual. 39:1848–1857.
- VOGELS, G.D. AND VAN DER DRIFT, C. (1976). Degradation of purines and pyrimidines by micro-organisms. Bacteriological Reviews 40:403.
- NAHM, K.H. (2003). Evaluation of the nitrogen content in poultry manure. Worlds Poult. Sci. J. 59:77–88.
- RITZ, C.W., FAIRCHILD, B.D., LACK, M.P., (2004). Implications of ammonia production and emissions from commercial poultry facilities: a review. Appl. Poult. Res. 13, 684-692.
- KIM, W.K., AND P.H. PATTERSON. (2003). Effect of minerals on activity of microbial uricase to reduce ammonia volatilization in poultry manure. Sci. 82:223–231.
- ROTHROCK, M.J., JR., K.L. COOK, N. LOVANH, J.G. WARREN, AND K. SISTANI. (2008-A). Development of a quantitative real-time PCR assay to target a novel group of ammonia producing bacteria found in poultry litter. Sci. 87:1058–1067.
- ROTHROCK, M.J., JR., K.L. COOK, J.G. WARREN, AND K. SISTANI. (2008-B).The effect of alum addition on poultry litter microbial communities. Sci. 87:1493–1503.



